职位推荐
- 珍格医疗-临床销售 15001-20000
- 地奥制药-医药代表 6001-8000
- 普利德医疗-医疗设备销售经理 面议
- 大唐-兼职招商经理 面议
- 景德中药-直营经理 6001-8000
- 安邦医药-省区招商经理 8001-10000
- 恒瑞医药-医药信息沟通专员 6001-8000
- 黄河中药-学术讲师 8001-10000
发布日期:2020-05-31 浏览次数:360

美国临床肿瘤学会(ASCO)是全球最大的临床肿瘤学术团体,成立于1964年,截至2020年已经拥有来自150多个国家或地区的4.5万会员,其中美国以外会员占三分之一。全球规模最大的临床肿瘤学术会议、第56届美国临床肿瘤年会于2020年5月29日首次以线上形式隆重开幕。
本届ASCO年会开幕当天,中国恒瑞医药原创新药吡咯替尼(艾瑞妮)治疗HER2阳性晚期乳腺癌的PHOEBE三期临床研究结果备受瞩目,荣登ASCO年会口头报告环节,恒瑞医药隆重举办“PHOEBE荣耀之夜”,数万人在同一时间共同见证了吡咯替尼登上世界最高学术会议的高光时刻。这不仅是恒瑞医药的“荣耀之夜”,也是我们整个中国临床肿瘤治疗领域的“荣耀之夜”。

共享荣耀,顶级专家罕见同框
在“荣耀之夜”上,中国乳腺癌治疗领域的顶级专家悉数到场。中国医学科学院肿瘤医院徐兵河教授、解放军总医院第五医学中心江泽飞教授、复旦大学附属肿瘤医院吴炅教授、复旦大学附属肿瘤医院胡夕春教授、中国医学科学院肿瘤医院马飞教授等乳腺癌殿堂级专家“同框”,共同支持中国原研亮相世界舞台,成为了盛典最大的“惊喜”。
不仅如此,同济大学附属上海市肺科医院周彩存教授、复旦大学附属肿瘤医院吴小华教授等其他肿瘤领域的顶尖专家也都来到现场,表达了对中国自主创新药的支持。
此外,恒瑞医药多位高管到场,恒瑞医药副总经理兼首席医学官邹建军博士参与对话环节,共谈中国原研的“荣耀之路”。

此次恒瑞医药“荣耀之夜”以多地连线的方式举行,来自北京、上海主会场,和全国其他十多个分会场的嘉宾出席了盛会,另有众多关注中国肿瘤医学发展的观众通过线上直播的形式一齐参与。
通过“荣耀之夜”,众多医师、学者以及关注肿瘤医学进展者共同领略了世界最高水平肿瘤研究。相比以往只有少数人才能亲临ASCO年会的现场,“荣耀之夜”的创新之举开创了行业的先河。
共话荣耀,吡咯替尼十年磨一剑
不同于传统学术会议的形式,在“荣耀之夜”上,恒瑞医药特别设置了专家学者的访谈环节,将现场打造成了一场乳腺癌领域的迷你“达沃斯峰会”。
作为我国首个国产1.1类抗HER2创新药,吡咯替尼从药物发现到上市获批共历时十年之久,可谓是真正的“十年磨一剑”,且始终因出色的疗效而备受关注。
徐兵河教授表示,吡咯替尼在一期临床阶段即表现出极高的客观缓解率,这使得他有信心大胆将拉帕替尼联合卡培他滨作为对照组。从结果来看,吡咯替尼不负众望,各项临床研究结果都完胜进口药物拉帕替尼。

另一方面,中国抗癌协会乳腺癌诊治指南与规范(2019年版)、中国临床肿瘤学会乳腺癌诊疗指南(2020年版)也将吡咯替尼列入了HER2阳性晚期乳腺癌二线治疗推荐,这也是迄今为止国产药在指南中的地位首次超越进口药。
江泽飞教授指出,目前国内的抗HER2药物较少,吡咯替尼这一国人原创药物填补了患者需求的空白。吡咯替尼因其出色的临床研究结果和其他良好的准入条件被列入一级推荐,这势必将改变晚期乳腺癌领域的治疗模式,帮助到更多患者。

对于未来吡咯替尼的发展,吴炅教授则认为,除了治疗晚期乳腺癌,吡咯替尼应该进入更早期的新辅助治疗阶段,惠及更多早期乳腺癌患者。他透露,相关临床研究有望在2020年年底和2021年年中的时候获得突破性的进展。

看到吡咯替尼的一些列卓越的成绩,邹建军博士表示,最大的感受是骄傲和感谢。吡咯替尼作为中国首个以二期临床研究结果就获批上市的国产创新药,离不开众多研究者、患者及其家属的大力支持,而上市后短短不到两年的时间里就惠及上万患者,是对所有努力最好的回报。

见证荣耀,中国诞生“Best in Class”
晚上9时,即美国芝加哥时间早上8时,ASCO年会的吡咯替尼PHOEBE研究口头报告正式开始。徐兵河教授通过视频方式向全球展示了PHOEBE研究的详细成果。
PHOEBE研究是一项吡咯替尼联合卡培他滨用于晚期HER2阳性乳腺癌二线治疗的三期临床研究。结果显示,与拉帕替尼相比,吡咯替尼的中位无进展生存达12.5个月、进展或死亡风险减少61%,客观缓解率达67.2%、提高15.6%,临床获益率达73.1%、提高14.0%,中位持续缓解时间达11.1个月、持续缓解率达70.0%。即使对于曲妥珠单抗耐药患者,中位无进展生存仍达12.5个月、进展或死亡风险减少40%。
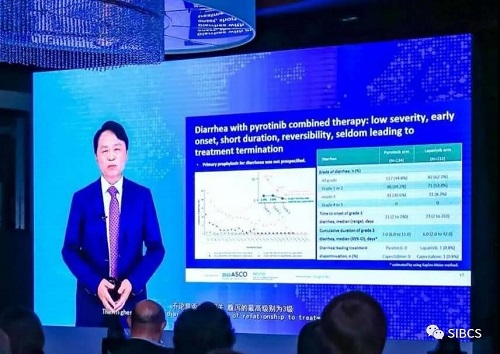
徐兵河教授表示,PHOEBE研究结果足以证明吡咯替尼的疗效,在小分子酪氨酸激酶抑制剂(TKI)类药物中,已处于“best in class”的地位。这一成绩值得每个人由衷地感到自豪。
作为吡咯替尼一到三期临床研究自始至终的重要研究者,马飞教授认为,过去国内的药物主要以仿制和跟随为主,吡咯替尼作为第一个取得“best in class”成绩的国产原研药,可以说是中国医药研发的一个分水岭,也是我国医药研发崛起的标志。

参与吡咯替尼PHOEBE研究的分中心研究者们也通过网络连线、祝福视频的方式共同庆祝这份“荣耀”。
中山大学附属肿瘤医院王树森教授指出,吡咯替尼的临床研究改变了过去高水平临床研究主要研究者都是国外研究者的局面,是中国临床研究的一大进步。中国科学院大学附属肿瘤医院(浙江省肿瘤医院)王晓稼教授高度赞扬吡咯替尼所取得的成绩和确切疗效获益,更是开创了国产药连续两年登顶ASCO年会口头报告的先河。
哈尔滨医科大学附属肿瘤医院(黑龙江省肿瘤医院)张清媛教授提到,以吡咯替尼为代表的中国原研药发展将惠及更多中国患者,推动中国医疗事业不断向前迈进。湖南省肿瘤医院中(南大学湘雅医学院附属肿瘤医院)欧阳取长教授参与了吡咯替尼二期和PHOEBE三期研究,他认为对于HER2阳性晚期乳腺癌患者,二线治疗应首先使用吡咯替尼治疗,他分别从临床数据、指南推荐和医保三方面总结吡咯替尼的“首选”优势。其中特别提到,在EMILIA研究中,T-DM1与拉帕替尼+卡培他滨相比,中位无进展生存为9.6个月比6.4个月,进展或死亡风险减少44%,而吡咯替尼+卡培他滨与拉帕替尼+卡培他滨相比,中位无进展生存为12.5个月比6.8个月,进展或死亡风险减少61%,研究数据是目前最好的。江苏省肿瘤医院(南京医科大学附属肿瘤医院)张莉莉教授充分肯定了吡咯替尼的潜力,她表示,期待更多有关吡咯替尼联合疗法的研究成果不断涌现。
随着PHOEBE研究结果公布,“花咯谁家”这一在过去两个月中吸引了众多医药行业人士参与的临床研究结果竞猜也迎来了“大结局”。“荣耀之夜”上,马飞教授对“花咯谁家”的最终结果进行了揭晓。
再创荣耀恒瑞多品种布局国际化开发
随着我国药品审评审批制度的改革不断深化,近年来我国创新药研究的步伐明显加快。如何进一步将国产创新药推向国际,实现“弯道超车”是许多专家共同的愿望。在这方面,不少专家均认为,恒瑞医药的产品非常有希望实现这一愿景。
据胡夕春教授介绍,其正在进行的一项针对曲妥珠单抗耐药HER2阳性晚期乳腺癌患者吡咯替尼一线治疗临床研究有希望在国际上提出第一个证据,证明吡咯替尼针对该患者人群依然有效。

周彩存教授则透露,从目前其牵头的一系列吡咯替尼治疗HER2阳性肺癌患者临床研究来看,吡咯替尼的效果令人鼓舞,“完胜”其他药物。未来相关临床研究还将进一步覆盖美国、欧洲、日本等国家和地区,力争让国产原研药也能入选国际肺癌治疗指南。

除了吡咯替尼,恒瑞医药另一款重磅免疫治疗药物——卡瑞利珠单抗也正在向国际化方向不断迈进。吴小华教授介绍,就在2020年3月28日,卡瑞利珠单抗联合法米替尼治疗铂耐药复发性卵巢癌、输卵管癌或原发性腹膜癌的二期临床研究登上了美国妇科肿瘤学会(SGO)第51届年会的舞台,取得了国际妇科肿瘤同行的高度认可。

邹建军博士表示,“原研”和“国际化”是恒瑞医药重要的两项战略。恒瑞有自信,未来将有更多的“best in class”产品,造福中国乃至全球患者;除此之外,恒瑞将努力开发全新靶点,创造出真正的“first in class”的产品,推动全球医疗事业的发展。

从“me too”,到“me better”,再到“me best”乃至“follow me”,中国医药从追随到原创,走过了漫长的转型历程。昨日的“荣耀之夜”不仅一次是对吡咯替尼PHOEBE研究的祝贺,更是对中国原研之路的一次总结与展望。
创新是一个民族进步的灵魂,也是国家兴旺发达的不竭动力。眼下,中国创新药的黄金时代已经来到。我们期待在不远的将来,以恒瑞医药为代表的中国医药产业,将开出更多惊艳世界的创新之花,让更多患者因中国创新药而获得生命的希望。
相关链接

J Clin Oncol. 2020;38:15_suppl:1003.
Pyrotinib or lapatinib plus capecitabine for HER2+ metastatic breast cancer (PHOEBE): A randomized phase III trial.
Binghe Xu, Min Yan, Fei Ma, Xi-Chun Hu, Ji Feng Feng, Quchang Ouyang, Zhongsheng Tong, Huiping Li, Qingyuan Zhang, Tao Sun, Xian Wang, Yongmei Yin, Ying Cheng, Wei Li, Xiaoyu Zhu, Chunxia Chen, Jianjun Zou, The PHOEBE Group.
National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing, China; The Affiliated Cancer Hospital of Zhengzhou University & Henan Cancer Hospital, Zhengzhou, China; Fudan University Cancer Hospital, Shanghai, China; Jiangsu Cancer Hospital, Jiangsu, China; Hunan Cancer Hospital, Changsha, China; Tianjin Medical University Cancer Institute and Hospital, Tianjin, China; Beijing Cancer Hospital, Beijing, China; Harbin Medical University Cancer Hospital, Harbin, China; Liaoning Cancer Hospital and Institute, Liaoning, China; Zhejiang University School of Medicine Sir Run Run Shaw Hospital, Hangzhou, China; The First Affiliated Hospital of Nanjing Medical University, Nanjing, China; Jilin Cancer Hospital, Changchun, China; The First Bethune Hospital of Jilin University, Jilin, China; Jiangsu Hengrui Medicine Co., Ltd, Shanghai, China.
BACKGROUND: Pyrotinib (an irreversible pan-ErbB inhibitor) plus capecitabine showed clinically meaningful benefits and acceptable tolerability in patients (pts) with HER2+ metastatic breast cancer (MBC) in phase 1 and 2 studies.
METHODS: This open-label, multicenter, randomized phase 3 study enrolled HER2+ MBC pts after trastuzumab and taxanes, and/or anthracyclines. Up to two prior lines of chemotherapy (chemo) for metastatic disease were allowed. Pts were randomly assigned (1:1) to receive pyrotinib 400 mg or lapatinib 1250 mg qd continuously plus capecitabine 1000 mg/m2 bid on days 1-14 of 21-day cycles. The primary endpoint was progression-free survival (PFS) per blinded independent central review.
RESULTS: From Jul 2017 to Oct 2018, 267 pts were randomized to the pyrotinib (n=134) or lapatinib (n=133) arm. One pt in the lapatinib arm did not receive study treatment and was excluded from analyses. 42.5% and 34.8% of pts in the pyrotinib and lapatinib arm had no prior chemo for metastatic disease, 41.8% and 49.2% had one prior line, and 15.7% and 15.9% had two lines. At the planned interim analysis, the median PFS was 12.5 months (95% CI 9.7-not reached) with pyrotinib plus capecitabine vs 6.8 months (95% CI 5.4-8.1) with lapatinib plus capecitabine (HR 0.39 [95% CI 0.27-0.56]; P<0.0001), which met the criterion for statistical significance (≤0.0066). Among trastuzumab-resistant pts, prolonged PFS with pyrotinib plus capecitabine was also observed (12.5 months [95% CI 6.9 to not reached] vs 6.9 months [95% CI 5.4 to not reached]; HR 0.60 [95% CI 0.29 to 1.21]). Benefits in objective response rate, clinical benefit rate, and duration of response with pyrotinib plus capecitabine were also indicated (Table). The most common grade ≥3 adverse events were diarrhea (30.6% vs 8.3% in the pyrotinib vs lapatinib arm) and hand-foot syndrome (16.4% vs 15.2%).
CONCLUSIONS: In pts with HER2+ MBC after trastuzumab and chemo, pyrotinib plus capecitabine achieved a significant better PFS than lapatinib plus capecitabine, with manageable toxicity, verifying the phase 2 findings.
CLINICAL TRIAL INFORMATION: NCT03080805
RESEARCH FUNDING: Jiangsu Hengrui Medicine
DOI: 10.1200/JCO.2020.38.15_suppl.1003
300多万优质简历
17年行业积淀
2万多家合作名企业

微信扫一扫 使用小程序

