职位推荐
- 珍格医疗-临床销售 15001-20000
- 地奥制药-医药代表 6001-8000
- 普利德医疗-医疗设备销售经理 面议
- 大唐-兼职招商经理 面议
- 景德中药-直营经理 6001-8000
- 安邦医药-省区招商经理 8001-10000
- 恒瑞医药-医药信息沟通专员 6001-8000
- 黄河中药-学术讲师 8001-10000
发布日期:2024-10-21 浏览次数:52
在9月下旬闭幕的全球最具影响力肿瘤学会议之一——2024年欧洲肿瘤内科学会(ESMO)大会上,恒瑞医药共亮相了13款创新药共37项抗肿瘤领域的研究成果,展现了强大的综合研发创新能力。
其中公司Claudin18.2 ADC创新药SHR-A1904、TROP-2 ADC创新药SHR-A1921、抗PD-L1/TGF-βRII双功能融合蛋白瑞拉芙普-α注射液(SHR-1701)、VEGFR2抑制剂阿帕替尼、PARP抑制剂氟唑帕利等5款创新药相关研究在大会现场以口头报告的形式重磅发表,备受肿瘤学界瞩目。
今日,本文特对2024 ESMO大会重点研究做梳理,一起来领略恒瑞医药在抗肿瘤领域的突破性学术成果。
2024 ESMO年会,恒瑞医药产品相关研究5项入选口头报告
01 SHR-A1904有望为胃癌/胃食管结合部腺癌患者带来治疗新选择
9月15日,中山大学肿瘤防治中心徐瑞华教授以口头报告的形式公布了一项SHR-A1904用于Claudin18.2(CLDN18.2)阳性的胃癌/胃食管结合部腺癌(GC/GEJC)患者的安全性和疗效Ⅰ期临床研究的初步数据1。
SHR-A1904是恒瑞医药自主研发且具有知识产权的靶向CLDN18.2的ADC药物。有效性方面,SHR-A1904在6.0mg/kg剂量组中,客观缓解率(ORR)达到55.6%,疾病控制率(DCR)为88.9%。安全性方面,SHR-A1904显示出良好的耐受性,并且未达到MTD,表明在研究使用的最高剂量下,药物的安全性仍是可接受的。
徐瑞华教授表示:“此次SHR-A1904取得了出色的研究数据,我认为有两点重要的意义。其一,这是国内制药企业在药物研发前沿领域、热点领域展现中国智慧的体现。目前,CLDN18.2这一肿瘤新靶点领域的临床探索可谓是百花齐放,风起云涌。SHR-A1904作为国内制药企业原研的创新药物,能够在这一领域领先布局,勇于探索,且能够取得不错的有效性数据,这是令我们欣慰的事。其二,胃癌是我国疾病负担最为严峻、未尽之需最为显著的恶性肿瘤之一。我国是胃癌高发大国,年新发病例数约占全球的40%。解决胃癌问题,对于我国患者来说、对于助力健康中国建设来说,都是意义重大的事情。CLDN18.2在胃癌中有很高的表达率,针对该靶点展开胃癌新药研究,有望改善我国晚期胃癌的治疗现状,为患者带来显著的生存获益提升。”

2024 ESMO现场图:徐瑞华教授进行口头报告
研究背景:
晚期胃癌的患者预后很差。CLDN18.2是一种紧密连接蛋白,在多种肿瘤中高表达,尤其是在胃腺癌患者中(约44%-87%)。SHR-A1904是一种新型ADC,由靶向CLDN18.2的IgG1单克隆抗体、可裂解连接子和拓扑异构酶I抑制剂有效载荷组成。本I期临床研究旨在评估SHR-A1904在标准治疗失败或无标准治疗的晚期实体瘤患者中的安全性和有效性。我们本次呈现了SHR-A1904在经治的CLDN18.2阳性GC/GEJC患者中的研究结果。
研究方法:
本Ⅰ期临床试验分为3个阶段。剂量递增阶段采用i3+3设计,患者接受0.6–8.0mg/kg(Q3W IV)的SHR-A1904。在药代动力学(PK)拓展阶段,选择可耐受的剂量组,每个剂量组拓展至8-12例受试者;在疗效拓展阶段,选择特定适应症的队列接受最佳剂量的SHR-A1904治疗。主要目的是评估安全性和耐受性并确定剂量限制毒性(DLT)、最大耐受剂量(MTD)和推荐的2期剂量(RP2D)。
研究结果:
截至2024年3月18日,共入组73名GC/GEJC患者(剂量递增阶段:29例;PK和疗效拓展阶段:44例)。其中72例(98.6%)患者存在远处转移,23例(31.5%)患者接受过≥3线既往治疗。在剂量递增阶段,4.8mg/kg组的2例患者和6.0mg/kg组的1例患者出现DLT,研究未达到MTD,选择6.0和8.0mg/kg剂量进行拓展。单次给药后,SHR-A1904和总抗体的暴露量在0.6–8.0 mg/kg剂量范围内大致成比例增加。SHR-A1904在6.0mg/kg剂量下t1/2为6.5天,在8.0mg/kg剂量下为6.0天。在疗效可评估集中,6.0和8.0mg/kg剂量组的ORR分别为55.6%(5/9;95%CI 21.2–86.3)和36.7%(11/30;95%CI 19.9–56.1);DCR分别为88.9%(8/9;95%CI 51.8–99.7)和86.7%(26/30;95%CI 69.3–96.2)。
研究结论:
在经治的CLDN18.2阳性GC/GEJC患者中,SHR-A1904显示出可控的安全性和良好的抗肿瘤活性,将继续随访评估长期疗效。
02 SHR-A1921有望改变铂耐药复发上皮性卵巢癌的治疗现状
9月15日,湖南省肿瘤医院唐迪红教授以简短口头报告的形式公布了“SHR-A1921治疗铂耐药卵巢癌(PROC)的首次人体I期研究数据2。约85%的上皮性卵巢癌患者在经过以铂类为基础的化疗治疗后终会发展到对铂类耐药,这部分患者即为PROC。PROC预后不良并且几乎没有有效的治疗选择。SHR-A1921单药治疗复发性铂耐药卵巢癌的ORR大于40%,且缓解具有可持续性;中位无进展生存期(PFS)达到7个月左右;推荐剂量下安全性可控、耐受性良好。SHR-A1921的进一步开发有望改变铂耐药复发上皮性卵巢癌的治疗现状。

2024 ESMO现场图:唐迪红教授进行口头报告
研究背景:
SHR-A1921 ADC药物由人源化抗Trop-2 IgG1单克隆抗体通过基于四肽的可裂解接头连接至DNA拓扑异构酶I抑制剂组成。本研究是一项三阶段的首次人体试验。SHR-A1921在晚期实体瘤患者中显示出可控的安全性和良好的抗肿瘤活性3。在此,我们呈现了SHR-A1921在PROC患者中的结果。
研究方法:
PROC定义为无铂治疗间期(PFI)<6个月。无论TROP-2表达水平如何,患者均可入组。根据前期研究结果显示,SHR-A1921的MTD为4.0mg/kg Q3W。因此,我们选择了两个可耐受剂量水平进行优化,即3.0mg/kg(D1,Q3W)和2.0+2.0mg/kg(D1和D8,Q3W)。
研究结果:
研究共入组了46名PROC患者(3.0mg/kg,n=26;2.0+2.0 mg/kg,n=20)。39.1%的患者被诊断为原发性铂耐药(即一线铂类化疗后PFI<6个月);34.8%的患者在最近一次铂类化疗后PFI<4周。多数患者经过多线治疗(≥2线铂类化疗:78.3%;铂耐药后接受过≥1线非铂类化疗:45.7%;贝伐单抗:69.6%;PARP抑制剂:58.7%)。截至2024年3月20日,中位随访时间为7.4个月(范围0.9-22.7)。在全部可评估患者中,ORR为48.8%(21/43;95% CI 33.3-64.5),DCR为97.7%(42/43; 95% CI 87.7-99.9)。中位DoR为6.4个月(95% CI 4.7-未达到)。获得缓解的21例患者中,10(47.6%)例患者仍在缓解中。中位PFS为7.2个月(95% CI 4.4-11.1)。中位OS未达到,6个月OS率为91.9%(95% CI 76.9-97.3)。SHR-A1921在3.0mg/kg和2.0+2.0mg/kg剂量下均有效。
研究结论:
SHR-A1921在PROC患者中表现出良好的疗效和可控的安全性。目前正在准备一项关键III期研究(NCT06394492)。
03 阿帕替尼有望为转移性骨肉瘤患者治疗提供新策略
9月13日,上海交通大学医学院附属瑞金医院张伟滨教授研究团队的鲍其远教授在现场简短口头报告了一项VEGFR2抑制剂阿帕替尼(Apa)联合化疗用于骨肉瘤可切除肺转移的开放标签、单臂Ⅱ期临床试验(PROACH研究)的结果4。可切除的转移性骨肉瘤的目前进展十分有限,该研究首次验证了在标准化疗基础上加入抗血管生成药物阿帕替尼,对于可切除的转移性骨肉瘤患者而言,有望成为一种新的治疗策略。

2024 ESMO现场图:鲍其远教授进行口头报告
研究背景:
血管内皮生长因子受体(VEGFR)靶向的酪氨酸激酶抑制剂在治疗复发性和不可切除骨肉瘤方面已取得许多重大突破5。然而,应用于可切除的转移性骨肉瘤的进展还很有限。
研究方法:
本研究旨在探索VEGFR2抑制剂阿帕替尼(Apa)联合吉西他滨-多西他赛(Gem-tax)化疗方案对骨肉瘤可切除肺转移(PMs)患者的治疗效果。通过PROACH研究(NCT03742193),本研究系统地评估了阿帕替尼联合Gem-tax新辅助治疗,后续以阿帕替尼单药维持治疗的策略在改善患者预后方面的潜力。入组患者在接受肺转移灶切除术前完成三个周期的阿帕替尼+Gem-tax治疗,术后辅助治疗四个周期后序贯使用阿帕替尼单药维持直至疾病进展(PD)或不可耐受毒性。若39例可评估疗效患者中有≥17例的患者达到达到无进展状态(历史对照为<30%),则达到主要终点。
研究结果:
从2019年3月到2022年11月,本研究共纳入43例符合条件的可切除骨肉瘤肺转移(PM)患者。基线数据显示,28%的患者存在≥10个肺转移灶,而56%的患者有双侧肺转移。采用新辅助阿帕替尼+Gem-Tax方案治疗后,91%(39/43)的患者成功完成了预定的转移瘤切除术,研究观察到18例(46.2%)可评价患者在12个月时仍处于无进展状态,满足了预设的主要终点标准。中位无进展生存期(mPFS)为12.8个月,中位生存期(mOS)达到42.1个月,术前71%的肿瘤出现不同程度缩小和降期。术后二年以上仍有约40%处于无瘤生存状态。本研究中肺转移手术后肿瘤标本中位肿瘤非活细胞比率高达90%(范围:35%-100%),这一数据显著优于仅Gem-Tax治疗的历史对照结果。
研究结论:
该研究首次验证了在标准化疗基础上加入抗血管生成药物阿帕替尼,对于可切除的转移性骨肉瘤患者而言,有望成为一种新的治疗策略。
04 SHR-1701有望为HER2阴性胃或胃食管结合部腺癌患者带来新希望
9月16日,北京大学肿瘤医院彭智教授以简短口头报告的形式公布了“SHR-1701联合化疗对比安慰剂联合化疗用于HER2阴性胃或胃食管结合部腺癌(G/GEJA)晚期一线的3期临床研究”数据6。该研究由北京大学肿瘤医院沈琳教授担任主要研究者。
针对HER2阴性晚期G/GEJA的免疫治疗已经有多项大型的多中心临床研究开展。相较而言,SHR-1701所取得的疗效数据显著,尤其是在降低疾病进展和死亡风险层面(HR值)。在意向治疗人群(ITT)中的中位总生存期(OS)为15.8个月 vs 11.2个月,HR为0.66(95%Cl 0.53-0.81),p<0.0001,降低34%的疾病进展或死亡风险;在PD-L1 CPS≥5人群中,中位OS为16.8个月 vs 10.4个月,HR为0.53(95%Cl 0.40-0.68),p<0.0001,降低47%的疾病进展或死亡风险。该结果显示,SHR-1701联合化疗一线治疗HER2阴性G/GEJA患者OS获益显著,有望为此类患者提供治疗新选择。

2024 ESMO现场图:彭智教授进行口头报告
研究背景:
SHR-1701是一种抗程序性死亡分子配体1/转化生长因子β受体II(Anti-PD-L1/TGF-βRII)双功能融合蛋白。本研究旨在评估SHR-1701联合化疗在既往未经系统治疗的局部晚期或转移性 HER2阴性G/GEJA患者中的有效性和安全性。
研究方法:
本III期临床研究包括两个阶段。第1阶段安全性导入期的研究结果显示,SHR-1701与CAPOX(奥沙利铂+卡培他滨)联合使用的推荐剂量为30mg/kg Q3W。在多中心、随机、双盲的第2阶段研究中,患者随机(1:1)接受SHR-1701(30mg/kg,静脉注射,Q3W)联合CAPOX或安慰剂联合CAPOX。随机分层因素为 PD-L1 CPS(≥5 vs <5)、ECOG PS(0 vs 1)和腹膜转移(是 vs 否)。第2阶段的主要终点为PD-L1 CPS≥5人群和ITT人群的OS。
研究结果:
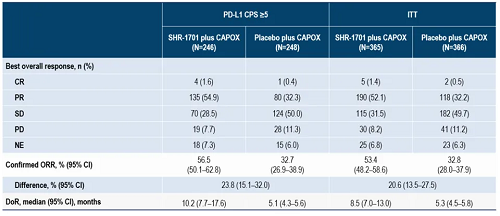
从2022年3月11日至2024年1月13日,365例患者被随机进入SHR-1701联合CAPOX组,366例进入安慰剂联合CAPOX组。数据分析截止日期为2024年5月20日,中位随访时间为8.5个月(IQR 5.6–13.2)。在PD-L1 CPS≥5的患者中,SHR-1701联合CAPOX相较于安慰剂联合CAPOX显著延长了OS(中位:16.8个月 vs 10.4个月;HR,0.53[95%CI 0.40–0.68];p<0.0001)。在ITT人群中,SHR-1701联合CAPOX组的中位OS同样显著优于安慰剂联合CAPOX组(中位:15.8 vs 11.2个月;HR,0.66 [95%CI 0.53–0.81];p<0.0001)。基于盲态独立影像评审委员会(BICR)评估,SHR-1701联合CAPOX也延长了PFS(PD-L1 CPS≥5人群:7.6个月 vs 5.5个月;HR,0.52[95%CI 0.42–0.66];ITT人群:7.0个月 vs 5.5个月;HR,0.57[95%CI 0.48–0.69])。此外,SHR-1701联合CAPOX组的BICR评估的ORR和DoR也优于安慰剂联合CAPOX组。
研究结论:
与安慰剂联合CAPOX方案相比,SHR-1701联合CAPOX方案用于一线治疗HER2阴性的G/GEJA患者,无论PD-L1 CPS≥5人群还是总体人群,均显示出统计学上显著且具有临床意义的OS获益,有望为该类患者提供新的治疗选择。
05 氟唑帕利、阿帕替尼有望为gBRCA突变的HER2阴性乳腺癌患者带来新选择
9月13日,北京大学肿瘤医院李惠平教授代表研究团队报告了一项氟唑帕利单药及联合阿帕替尼治疗gBRCA突变的HER2阴性乳腺癌的Ⅲ期临床试验(FABULOUS研究)7。研究结果显示,与标准化疗相比,氟唑帕利联合阿帕替尼或氟唑帕利单药均显著改善了患者的PFS,疾病进展风险分别降低73%和51%。截至本次数据分析时,该研究已达到主要终点。
李惠平教授表示,“这些结果不仅证实了氟唑帕利联合阿帕替尼以及氟唑帕利单药在治疗携带gBRCA突变的HER2阴性乳腺癌患者中的显著疗效,也为未来的治疗策略提供了重要的参考。期待未来有更多更深入的临床研究进一步探索氟唑帕利和阿帕替尼的联合应用及药物安全性。相信氟唑帕利单药或联合阿帕替尼治疗乳腺癌适应症获批后,将为gBRCA突变乳腺癌患者带来新的治疗选择。”

2024 ESMO现场图:李惠平教授进行报告
研究背景:
氟唑帕利是一种口服的PARP抑制剂,在携带BRCA突变的乳腺癌患者中展现出抗肿瘤活性。在妇科癌症的治疗中,抗血管生成药物联合PARP抑制剂已展现出显著的临床优势。因此,我们评估了氟唑帕利单药及联合VEGFR2抑制剂阿帕替尼在伴有gBRCA1/2突变的HER2阴性转移性乳腺癌患者中的有效性和安全性。
研究方法:
这是一项随机、开放标签、多中心、III期临床试验。患者被随机分配(1:1:1)接受氟唑帕利(100mg bid,口服)联合阿帕替尼(500mg qd,口服)、氟唑帕利(150mg bid,口服)或医生选择的标准化疗(卡培他滨或长春瑞滨)。化疗组患者在盲态独立影像评审委员会(BICR)评估的PD后,允许转为接受氟唑帕利单药治疗。研究的主要终点是BICR评估的PFS。
研究结果:
研究共纳入203名患者;其中,70名被分配接受氟唑帕利联合阿帕替尼,67名接受氟唑帕利单药治疗,66名接受标准化疗。与标准化疗相比,氟唑帕利联合阿帕替尼治疗的PFS显著延长(中位:11.0 vs 3.0个月;HR,0.27[95%CI 0.17-0.43];p<0.0001);氟唑帕利单药相较于标准化疗的PFS也显著延长(中位,6.7 vs 3.0个月;HR,0.49[95%CI 0.32-0.75];p=0.0004);氟唑帕利联合阿帕替尼的PFS优于氟唑帕利单药(HR,0.60[95%CI 0.40-0.91];p=0.0079)。此外,氟唑帕利联合阿帕替尼和氟唑帕利单药的中位OS都比标准化疗长(29.2个月和31.5个月 vs 21.5个月;HR,0.58[95%CI 0.33-1.02]和0.61 [95%CI 0.35-1.08])。在安全性方面,氟唑帕利联合阿帕替尼的不良事件谱与单药一致,未发生新的安全性信号。
研究结论:
在携带gBRCA突变的HER2阴性转移性乳腺癌患者中,氟唑帕利联合阿帕替尼及氟唑帕利单药与研究者选择的化疗相比,均取得了显著的且有临床意义的PFS改善,且安全可控。氟唑帕利联合阿帕替尼比单独使用PARP抑制剂可获得更好的PFS获益。氟唑帕利联合阿帕替尼及氟唑帕利单药比标准化疗显示出更好的OS获益趋势。
除了上述的5项口头报告,公司另有32项研究接收为壁报,覆盖食管胃癌、妇科肿瘤、肝癌、乳腺癌、胰腺癌、肺癌、黑色素瘤、胆道癌、头颈鳞癌、前列腺癌、甲状腺癌等十余个领域。

2024 ESMO年会,恒瑞医药产品共37项研究成功入选
作为创新型国际化制药企业,恒瑞医药长期坚持“科技为本,为人类创造健康生活”的使命,针对肿瘤等严重威胁人类生命健康的疾病开展科研攻关,已上市的17款创新药中抗肿瘤创新药达9款。公司另有90多个自主创新产品正在临床开发,300多项临床试验在国内外开展。本次ESMO大会,公司携13款创新药的37项抗肿瘤领域研究登上国际权威学术舞台,是中国医药研发创新力量的展现。未来,恒瑞医药将继续坚持“以患者为中心”的理念,力争研制出更多的新药、好药,服务“健康中国”,惠及全球患者。
参考文献:
1.CLDN18.2 targeted antibody-drug conjugate (ADC), SHR-A1904, in patients (pts) with gastric/gastroesophageal junction cancer (GC/GEJC): a phase 1 study.ESMO 2024:609O
2.SHR-A1921 in platinum-resistant ovarian cancer (PROC): data from a first-in-human (FIH) phase 1 study.ESMO 2024:717MO
3. AACR 2023;Presentation Number: CT181
4.The Final Results of Pulmonary Resectable Metastases of Osteosarcoma With Antiangiogenic and CHemotherapy (PROACH):An open-label, single-arm phase 2 clinical trial.ESMO 2024:1724MO
5.Harting MT, 2006; Leary, SES.2013;Liu Z, 2022
6.Phase 3 study of SHR-1701 versus placebo in combination with chemo as first-line (1L) therapy for HER2-negative gastric/gastroesophageal junction adenocarcinoma (G/GEJA).ESMO 2024:LBA60
7. Fuzuloparib with or without apatinib in HER2- metastatic breast cancer (mBC) patients (pts) with germline BRCA1/2 mutations (gBRCA1/2m): A randomized phase III trial. ESMO 2024:VP2-2024
300多万优质简历
17年行业积淀
2万多家合作名企业

微信扫一扫 使用小程序

